11月9日,奥林巴斯在收到四起患者严重受伤的不良事件投诉后,宣布一项自愿纠错行动。
目前,FDA已将这一措施标记为I级召回。召回原因是,如果在供氧时进行高频烧灼(和/或) 电外科附件的电极部分太靠近内窥镜的远端,则存在支气管内燃烧的风险。
患者可能会遭受气道或肺部烧伤,可能导致额外的医疗干预、延长手术时间、延长住院时间、ICU 护理和死亡。
FDA官网显示,此次召回涉及近68000台设备。全球有28款BF系列支气管内窥镜受到此次纠错行动的影响,其中有15款在美国销售。
支气管镜用于肺部气道的内窥镜诊断和治疗。 在10月12日给客户的一封信中,奥林巴斯警告医护人员在含氧环境中使用奥林巴斯支气管镜进行高频烧灼的风险,可能会导致燃烧。
奥林巴斯发言人表示,在目前收到的四份投诉中,一份涉及高频治疗设备,三份涉及未知的能量治疗设备。
FDA官网显示,以下型号的内窥镜受此次召回事件影响:


而在7月,奥林巴斯还曾发起一次关于内镜燃烧的单独纠错行动,并接到一人死亡的投诉。
2023 年 7 月 3 日奥林巴斯宣布了一项自愿纠错行动,以解决在治疗过程中将激光兼容支气管镜与激光治疗设备或氩等离子体凝固 (APC) 治疗设备结合使用时,发生的支气管内燃烧投诉。
奥林巴斯在收到涉及严重患者伤害和一人死亡的不良事件投诉后评估了该问题,并确定需要更新标签以指定激光兼容性,警告使用不兼容的激光治疗设备可能导致的风险,并加强现有的激光使用警告。
这一纠错行动共涉及全球范围内32款BF系列内窥镜型号。其中19个在美国销售。
近期,奥林巴斯也在国内发起了多次召回。
11月
11月1日,国家药监局官网发布召回信息,其中包括奥林巴斯发起的两个二级召回。
1.奥林巴斯贸易(上海)有限公司报告,由于涉事产品检查卡的吸气量规格错误等原因,生产商奥林巴斯医疗株式会社对其生产的纤维气管插管内窥镜(国械注进20142065689)主动召回。召回级别为二级召回。
2.奥林巴斯贸易(上海)有限公司报告,由于涉事产品维修不当等原因,生产商奥林巴斯医疗株式会社对其生产的电子上消化道内窥镜(国械注进20153063036)主动召回。召回级别为二级召回。
10月
10月7日,国家药监局官网发布信息,奥林巴斯贸易(上海)有限公司报告,由于供应商提供的部分手柄不合格等原因,生产商奥林巴斯医疗株式会社对其生产的一次性使用双极高频超声双输出手术器械(国械注进20203010020)主动召回。召回级别为二级召回。
8月
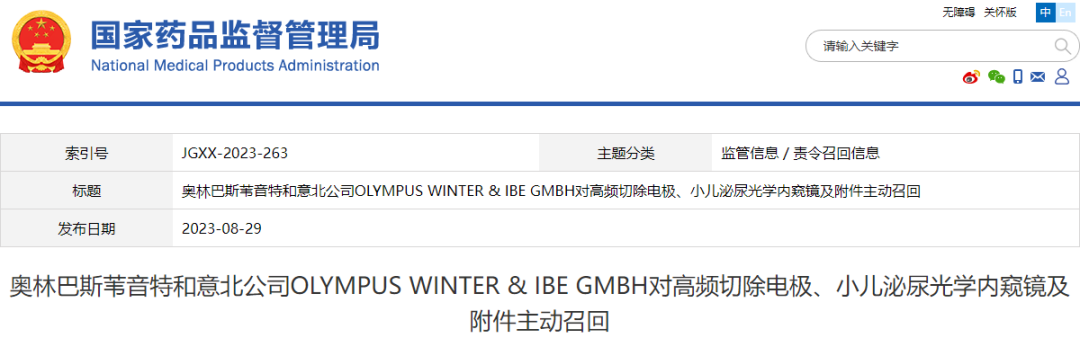
今年8月国家药品监督管理局官网显示,奥林巴斯贸易(上海)有限公司报告,由于日文说明书描述错误等原因,生产商奥林巴斯苇音特和意北公司对小儿泌尿光学内窥镜及附件Pediatric Urologies Telescopes & Accessories (国械注进20163063084)、高频切除电极(国械注进20153011433、国械注进20193011622)主动召回。召回级别为二级召回。
7月

今年7月,奥林巴斯贸易(上海)有限公司报告,由于部分产品缺失最终检验工作标准,生产商奥林巴斯医疗株式会社对电子胃镜(国食药监械(进)字2012第3220572号、国食药监械(进)字2013第3221990号)、电子大肠内窥镜大腸ビデオスコープ(国械注进20172067070)、电子结肠镜(国食药监械(进)字2012第3220852号、国食药监械(进)字2013第3224358号)、电子十二指肠镜(国食药监械(进)字2011第3222826号)、电子上消化道内窥镜(国械注进20153063036、国械注进20183062529)、电子十二指肠镜十二指腸ビデオスコープ(国械注进20163063273)主动召回。召回级别为三级召回。
香港地区停用
2023年11月5日,香港医院管理局发布通知,要求公立医院立即停用142个奥林巴斯气腹机。

受此影响,预计未来一星期有约30宗已预约于屯门医院、博爱医院及明爱医院的非紧急腹腔镜微创手术需要改期。
这一停用通知是受近期FDA发起的一级召回影响。
今年10月FDA官网显示,奥林巴斯已经对UHI-4高流速气腹机发起一级召回。

该产品用于腹腔镜检查或腹腔镜手术中,向腹腔注入二氧化碳气体。FDA官网显示产品召回原因是,有报告称患有心率失常的患者在使用UHI-4的外科手术中出现了短暂的心脏骤停,可能是由于使用 UHI-4 导致腹腔过度充气造成。

奥林巴斯发言人在一份电子邮件声明中表示,召回和纠正措施是FDA在对涉及严重患者受伤和一人死亡的不良事件投诉进行全面评估后采取的。
根据FDA的数据库,奥林巴斯于9月22日启动召回,共涉及在美国的3136台产品。此次UHI-4在美国召回涉及的产品编号如下:

奥林巴斯建议客户仔细阅读纠错信函,并向公司报告投诉,包括使用UHI-4进行手术过程中过度吹气造成的伤害。

据查证,UHI-4在中国也有销售,于2021年5月在国内获批,是市面上常见的气腹机型号之一。
目前奥林巴斯仍是国内主导的内窥镜品牌之一,并不断扩大在华业务。
众成数据显示,2023年上半年国内软镜公立医院中标排名中,奥林巴斯以13.9亿的中标金额夺得断层第一,市场占比高达42.85%。作为参考:排位第二的富士中标金额为6.7亿、市场占比为20.96%。
今年2月公司继续加码中国布局,宣布将在江苏苏州工业园区落地其中国医疗器械生产研发基地,4月正式动工。该项目初期总投资约6000万美元(折合人民币约为4.14亿元),未来将持续强化拓展制造和研发功能,成为奥林巴斯集制造、研发、采销及解决方案为一体的综合型全球战略基地。
这是奥林巴斯首次在中国设立医疗器械产品的生产研发基地,也是首次将核心产品放到日本以外地区生产。
暌违八年,最强新品上市

最近奥林巴斯还在中国推出了潜心研发8年之久的EVIS X1。2023年9月1日公司微信公众号宣布,EVIS X1主机CV-1500获得了中国国家药品监督管理局(NMPA)批准上市。
奥林巴斯从2020年开始在欧洲及日本等市场陆续推出EVIS X1,2023年10月在美国上市销售。此前在主要市场中,尚未引进EVIS X1的只有中国。
EVIS X1系统旨在帮助医生观察胃肠道出血和解剖结构,有多项增强功能。该技术通过将Evis Exera III系统中的氙灯换成五个LED灯来实现,这些灯可以产生除白光外的其他光线组合。
包括:
红色二色成像(RDI)技术
使用红色二色窄带光和绿色照明光进行光学-数字观察。纹理和色彩增强成像(TXI)技术
强调色调变化、图案和图像轮廓,纠正暗部的亮度。维持对比度的亮度调整成像(BAI-MAC)
维持内窥镜图像明亮部分的亮度,修正内窥镜图像黑暗部分的亮度。奥林巴斯的光学数字技术NBI(窄带成像)技术
加强了对粘膜组织的观察,其工作原理是将白光过滤成特定的光波,这些光波被血红蛋白吸收,只穿透人体组织的表面。正因如此,粘膜表面的毛细血管在显示器上显示为棕色,而粘膜下层的静脉则显示为青色。
EVIS X1研发及上市是奥林巴斯在消化内镜领域的又一重大里程碑,其市场表现备受期待。
(文章来源于互联网)




 全部商品分类
全部商品分类