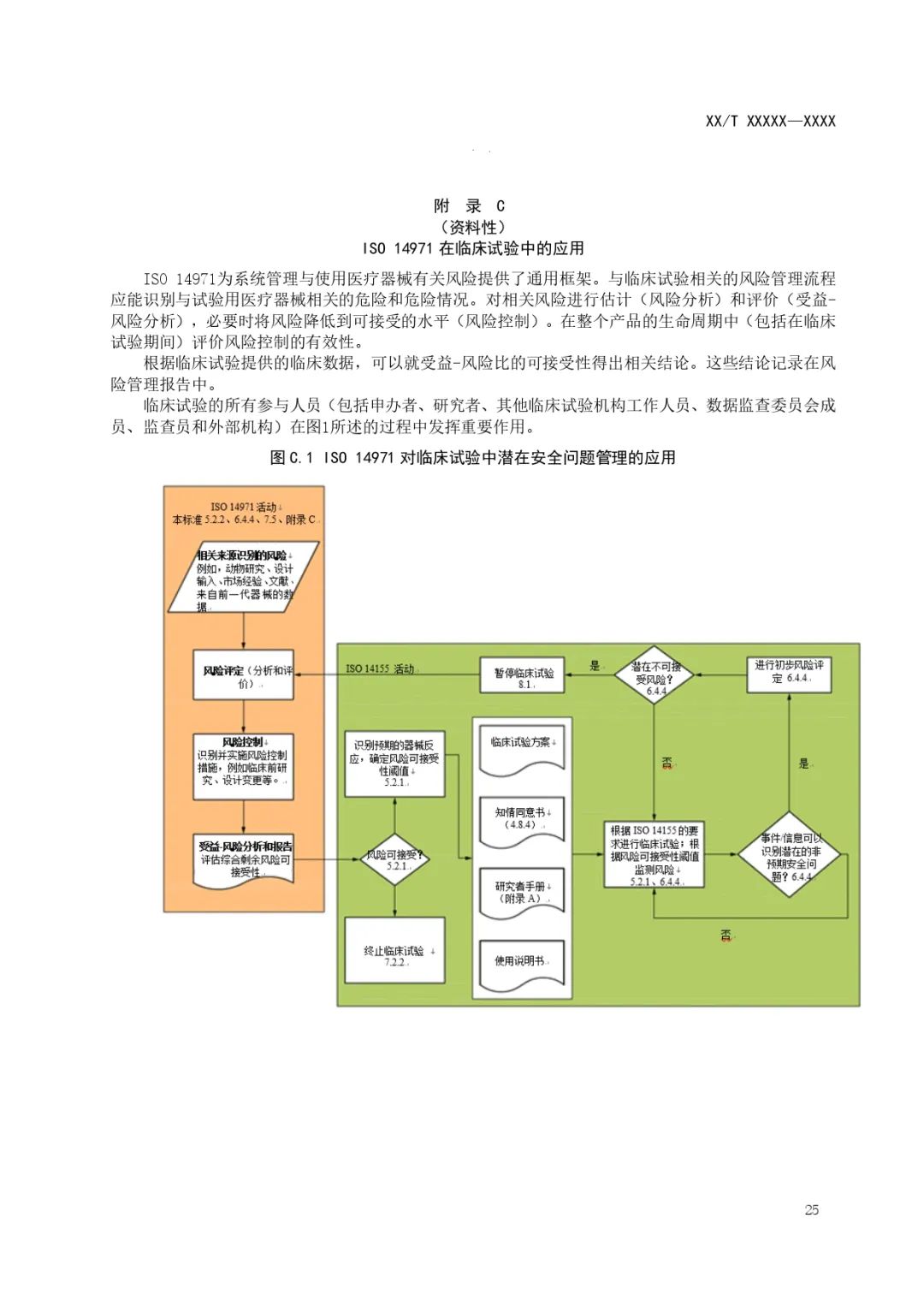
【CMDE】医疗器械和体外诊断试剂临床试验质量技术规范(征求意见稿)及编制说明

各相关单位和个人:
根据全国医疗器械临床评价标准化技术归口单位2023年关于标准制定的工作安排,我标准化技术归口单位已完成《医疗器械临床试验质量技术规范》《体外诊断试剂临床试验质量技术规范》2项行业标准征求意见稿等相关材料,建议上述2项标准发布12个月后实施,现面向社会公开征求意见。
请相关单位组织人员对标准征求意见稿、编制说明(附件1-2)和建议实施日期提出意见或建议,填写《标准征求意见反馈表》(附件3),于2023年10月31日前以电子邮件形式反馈至秘书处邮箱,邮件主题请注明标准名称。无意见也请邮件反馈说明。逾期未回复,视为无意见。
秘书处联系方式:
联系人:刘露(医疗器械)
电话:010-86452501
邮箱:liulu@cmde.org.cn
联系人:何静云(体外诊断试剂)
电话:010-86452544
邮箱:hejy@cmde.org.cn
附件:1.《医疗器械临床试验质量技术规范》(征求意见稿)及编制说明
2.《体外诊断试剂临床试验质量技术规范》(征求意见稿)及编制说明
3. 标准征求意见反馈表
全国医疗器械临床评价标准化技术归口单位
2023年9月4日
附件1:
《医疗器械临床试验质量技术规范》(征求意见稿)及编制说明


































附件2:
《体外诊断试剂临床试验质量技术规范》(征求意见稿)及编制说明






















(文章来源于互联网)




 全部商品分类
全部商品分类